Hemija je predmet koji se može učiti u srednjoj školi ili na univerzitetu kao dio daljeg obrazovanja. Neki su odlučili učiti više o hemiji zato što ih osnovni koncepti fasciniraju i žele proširiti svoje znanje, dok su drugi prisiljeni proučavati ovaj predmet tokom posljednjih godina srednje škole.
Iskreno, proučavanje hemije i njen značaj je nešto što se razvija s vremenom. Neće svi cijeniti ovu naučnu disciplinu koja uključuje ispitivanje hemijskih elemenata, hemijskih jedinjenja, molekula i jona. Razumijevanje njihove kompozicije, strukture, svojstava i ponašanja može biti nečija strast, a drugoj osobi pravi izazov.
Ipak, poznavanje osnova hemije uključujući periodni sistem elemenata donosi brojne prednosti jer je hemija poznata kao centralna nauka koja spaja matematiku, fiziku, biologiju i medicinu. Polje hemije je široko i obuhvata različite prakse, od kojih mnoge uključuju fascinantne teme koje će duboko zainteresovati svakog ljubitelja nauke. U našem članku možete saznati više o ključnim terminima u hemiji.
Hemija može biti dobra i loša stvar. Hemija je dobra kada se igrate s njom, a loša kada pravite drogu.
Adam Sandler
Bez daljnjeg odlaganja, u ovom tekstu predstavit ćemo nekoliko osnovnih pojmova hemije i njen značaj, kao što su hemijske veze, hemijske reakcije, elementi, Lewisova struktura, periodni sistem elemenata te tečnosti i gasovi.
Nije važno volite li nauku ili ne - ovaj tekst će vas uputiti u osnove hemije uključujući periodni sistem elemenata, omogućavajući vam da se snađete ako ova tema dođe u razgovoru!

Hemijske reakcije
Hemijske reakcije se dešavaju stalno. Bilo da kuhate, palite vatru ili dišete, hemijske reakcije se uvijek odvijaju.
Video prikazuje kako hemijske reakcije utiču na svakodnevne aktivnosti i materije oko nas. (Izvor: YouTube.com - Brainz TV)
U hemijskoj reakciji, molekuli ili joni se preuređuju i formiraju novu strukturu. Atomsko jezgro ostaje netaknuto, a samo se elektroni prenose kako bi se stvorile hemijske veze. Broj atoma iz hemijskih elemenata se ne mijenja i ostaje isti od početka do kraja reakcije. Ovo je otkriće Antoinea Lavoisiera, o kojem možete saznati više u našem članku o najpoznatijim hemičarima.
Važno je napomenuti da se hemijske reakcije razlikuju od fizičkih promjena. Najznačajnija razlika je u tome što u hemijskoj reakciji atomi formiraju nove proizvode, molekule i hemijska jedinjenja, dok kod fizičke promjene atomi zadržavaju istu strukturu kao ranije.
Promjena molekula tokom hemijske reakcije nije vidljiva golim okom. Ipak, postoje znakovi koji mogu pomoći da se uoči razlika, poput promjene temperature, pojave mehurića ili promjene boje.
Atomi i molekuli koji učestvuju u reakciji nazivaju se reaktanti, dok se atomi i molekuli koji nastaju tokom reakcije nazivaju produkti. Hemijska jednačina se zapisuje ovako:
reaktant1 + reaktant2 + ... -----> produkt1 + produkt2 + ...
Oni koji su proučavali osnove hemije uključujući periodni sistem elemenata mogu napisati jednačinu u skraćenom obliku:
a A + b B + ... -----> c C + d D + ...
Tipovi hemijskih reakcija
Hemijske reakcije predstavljaju procese u kojima se supstance međusobno transformišu, pri čemu nastaju nove materije sa drugačijim osobinama. U osnovnoj hemiji, one se dijele u četiri glavna tipa:
- Sinteza ili direktna kombinacija: reakcije u kojima se dvije ili više supstanci spajaju i formiraju jedno novo jedinjenje.
- Razlaganje (dekompozicija): proces u kojem se jedno jedinjenje razlaže na dvije ili više jednostavnijih supstanci.
- Jednostruka supstitucija (single replacement): reakcije u kojima jedan element zamjenjuje drugi u hemijskom jedinjenju.
- Metateza ili dvostruka zamjena (double displacement): reakcije u kojima dolazi do razmjene jona između dva jedinjenja.
Ovi primjeri pokazuju koliko su hemijske reakcije prisutne u našem okruženju i koliko utiču na svakodnevne procese. Ipak, ono što smo ovdje obradili predstavlja tek osnovu: stvarni svijet hemije je mnogo složeniji i bogatiji. Dublje razumijevanje ovih procesa pomaže u shvatanju hemije i njenog značaja, kako u nauci, tako i u praktičnom životu.
Ako vas ova tema zanima i želite proširiti svoje znanje, dodatni izvori i stručno vođeno učenje mogu vam pomoći da sigurnije savladate gradivo i povežete teoriju sa stvarnim primjerima.
Hemijski elementi i periodni sistem elemenata
Hemijski element je čista supstanca u svom najjednostavnijem obliku koja se ne može dalje rastaviti.
Do sada su naučnici otkrili 118 hemijskih elemenata. Od toga, 94 elementa se obično nalaze u prirodi, dok je preostalih 24 hemijska jedinjenja stvoreno umjetno. Najzastupljeniji element u svemiru je vodonik, a na Zemlji je gvožđe. Najčešći element u ljudskom tijelu i na Zemlji je kiseonik.
Element se sastoji od jednog atoma i karakteriše ga broj protona u jezgru tog atoma, poznat kao atomski broj i označen slovom Z.
Elementi koji nisu miješani i nalaze se u svom najčišćem obliku imaju isti broj protona, dok oni koji su mješavina sadrže različite atome i brojeve protona. Neki od potpuno čistih elemenata uključuju bakar, srebro, zlato i sumpor. Primjer mješovitog elementa je atmosferski zrak, koji je mješavina azota, kiseonika i argona.
Ukupan broj hemijskih elemenata u periodnom sistemu!
Primjere različitih hemijskih elemenata možete pronaći na periodnom sistemu elemenata. Prvi element, sa samo jednim protonom, je vodonik. Drugi element je helijum sa dva protona, a treći je litijum sa tri protona. Broj protona i elementi nastavljaju se na periodnom sistemu sve do 118, nedavno otkrivenog elementa oganesona.
Periodni sistem elemenata
Periodni sistem elemenata predstavlja najčešće korišten način raspoređivanja hemijskih elemenata. Elementi su organizovani prema atomskom broju, elektronskoj konfiguraciji i ponavljajućim hemijskim osobinama. Redovi u tabeli nazivaju se periode, dok se kolone označavaju kao grupe.
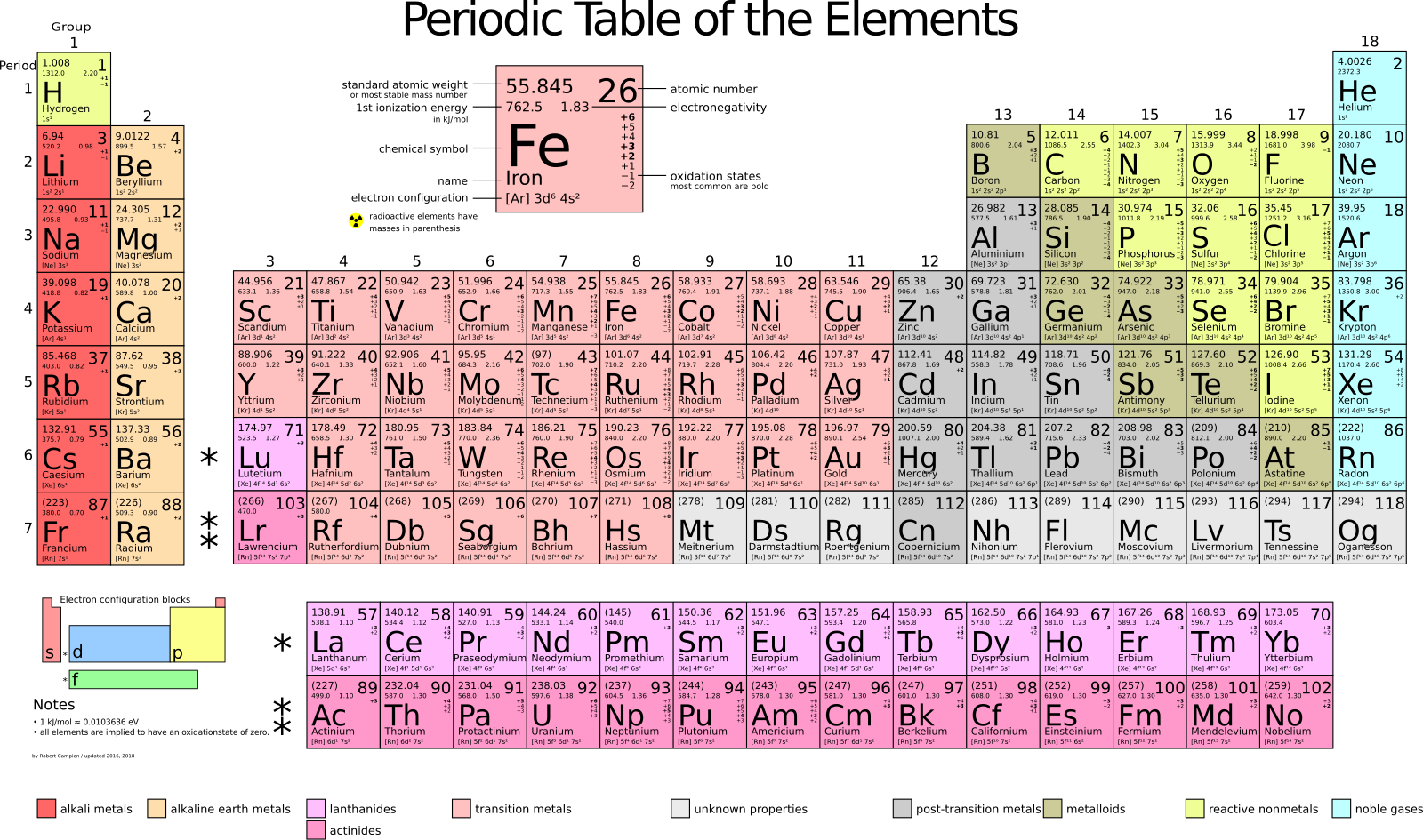
U periodnom sistemu postoji 18 grupa (kolona) koje okupljaju elemente sa sličnim hemijskim ponašanjem. Od tih 18 grupa, samo sedam ima zvanične i općeprihvaćene nazive:
- Grupa 1: alkalni metali
- Grupa 2: zemnoalkalni metali
- Grupa 15: pniktogeni
- Grupa 16: halkogeni
- Grupa 17: halogeni
- Grupa 18: plemeniti gasovi
Boje u pozadini elemenata u periodnom sistemu služe za označavanje podkategorija, poput metala, metaloida i nemetala. Važno je napomenuti da boje nisu standardizovane; postoje različite verzije periodnog sistema, a izbor boja često zavisi od ličnih ili obrazovnih preferencija. Ipak, osnovne kategorije elemenata ostaju iste u svim prikazima.
Učenje o periodnom sistemu može biti izuzetno zanimljivo i korisno jer pomaže u razumijevanju primjene i osobina različitih elemenata. Upravo su osnovi hemije uključujući periodni sistem elemenata temelj za dalje proučavanje hemije i njene primjene u nauci, industriji i svakodnevnom životu. A ako vas zanimaju fascinantne činjenice i anegdote iz hemije, pročitajte i ovaj naš članak.
Hemijske veze i Lewisova struktura
Hemijske veze predstavljaju privlačne sile između atoma, jona i molekula koje omogućavaju nastanak hemijskih jedinjenja. Ove veze mogu imati različitu jačinu, jer neke od njih - poput kovalentnih, jonskih i metalnih veza - spadaju u jake veze, dok su druge slabije, kao što su dipol-dipol interakcije, Londonove disperzione sile i vodonične veze.
Jake veze koje povezuju atome unutar molekula smatraju se relativno trajnim, dok su slabije veze privremene i lako se raskidaju. Bez obzira na njihovu jačinu, sve hemijske veze su neophodne za funkcionisanje materije, hemiju našeg tijela i sam život.
Grafički prikaz molekularnih modela koji pomaže u razumijevanju strukture i interakcija atoma. (Izvor: Google DeepMind - Pexels.com)
Razumijevanje hemijskih veza pomaže da shvatimo hemiju i njen značaj, jer upravo one određuju strukturu supstanci, njihova svojstva i reakcije koje se odvijaju u prirodi i laboratoriji.
Naučnici su otkrili da je najčešći razlog formiranja hemijskih veza težnja atoma da dostignu najstabilniji mogući energetski nivo. Atomi se povezuju kako bi njihova elektronska struktura postala stabilnija, što je osnovni princip hemijskih interakcija.
U hemiji, kao i u životu, suprotnosti se privlače. Privlačna sila između negativno nabijenih elektrona, koji kruže oko jezgra atoma, i pozitivno nabijenih protona, koji se nalaze unutar jezgra, stvara silu koja dovodi do formiranja hemijske veze.
Postoji više različitih tipova hemijskih veza, a najvažnije su sljedeće:
- Jonske veze
Ove veze nastaju između jona sa suprotnim električnim nabojem. Klasičan primjer je kuhinjska so. Pozitivno nabijeni natrijumovi joni i negativno nabijeni hloridni joni međusobno se privlače i formiraju natrijum-hlorid.
- Kovalentne veze
Kod kovalentnih veza atomi postaju stabilniji dijeljenjem elektrona, umjesto njihovim gubitkom ili primanjem. Ove veze su mnogo češće od jonskih u molekulima živih organizama. Što dva atoma dijele više elektrona, to je kovalentna veza jača.
- Polarne kovalentne veze
U ovom tipu veze elektroni se nejednako dijele između atoma i provode više vremena bliže jednom atomu nego drugom. Zbog neravnomjerne raspodjele elektrona dolazi do pojave djelimičnih naboja u različitim dijelovima molekula.
- Nepolarne kovalentne veze
Ove veze se formiraju između dva atoma istog elementa ili između atoma različitih elemenata koji jednako dijele elektrone, bez stvaranja djelimičnih naboja.
- Vodonične veze
Vodonične veze nastaju kod polarnih kovalentnih veza koje sadrže vodonik. Budući da su elektroni privučeni ka drugom elementu, atom vodonika dobija blago pozitivan naboj. Zbog toga se vodonik privlači negativno nabijenim dijelovima drugih molekula, što dovodi do stvaranja vodonične veze.
Razumijevanje ovih tipova veza ključno je za shvatanje kako funkcionišu supstance, biološki sistemi i hemijski procesi, te predstavlja važan dio znanja o hemijskim vezama i njihovoj ulozi u prirodi.
Lewisova tačkasta struktura (Lewis Dot Structure)
Lewisova tačkasta struktura prikazuje vezivanje između atoma i molekula, kao i slobodne parove elektrona koji mogu postojati unutar molekula. Ovaj prikaz pomaže u razumijevanju kako se atomi povezuju i kako su raspoređeni valentni elektroni.
Ovu strukturu je 1916. godine uveo Gilbert N. Lewis u svom radu The Atom and the Molecule. Lewisova tačkasta struktura proširila je koncept elektronskog dijagrama tako što su dodane linije koje predstavljaju dijeljene parove elektrona u hemijskoj vezi. Za uvid u najznačajnija otkrića i izume koji su oblikovali hemiju, pročitajte i ovaj naš članak.
Ona predstavlja brz i jednostavan način da se prikaže konfiguracija valentnih elektrona pojedinačnih atoma, posebno u slučajevima kada još nisu formirane veze ili prethodne interakcije između atoma.

Kiselost i baznost (Acidity and Basicity)
Supstance se mogu klasifikovati kao kiseline ili baze. Reakcija između kiseline i baze spada među najčešće hemijske reakcije i često se koristi za određivanje pH vrijednosti neke supstance ili tečnosti.
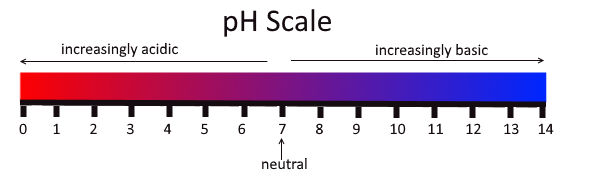
pH skala sa prikazom kiselih, neutralnih i baznih supstanci. (Izvor: Wikimedia Commons, autor: Christinelmiller, CC BY-SA 4.0)
Tokom historije hemije, mnogi naučnici razvili su različite teorije kiselina i baza kako bi preciznije definisali ove supstance, izračunali pH vrijednosti i bolje razumjeli njihove međusobne reakcije.
Arrheniusova teorija kiselina i baza
Ova teorija potiče iz 1884. godine i jedna je od najčešće korištenih i danas. Svante Arrhenius je svoja istraživanja bazirao na ponašanju soli u vodi.
Prema Arrheniusovoj teoriji:
- reakcije se odvijaju u vodenim rastvorima,
- kiseline proizvode H⁺ jone u vodenom rastvoru,
- baze proizvode OH⁻ jone,
- dozvoljene su samo protne kiseline,
- kao baze se prihvataju samo hidroksidi.
Lewisova teorija kiselina i baza
Ova teorija se smatra najmanje restriktivnom, jer se u potpunosti fokusira na elektronske parove, dok se protoni ne uzimaju u obzir.
Osnovni principi Lewisove teorije su:
- kiseline su prihvatači elektronskih parova,
- baze su davaoci elektronskih parova.
Brønsted-Lowryjeva teorija kiselina i baza
Prema ovoj teoriji, reakcije kiselina i baza se definišu kroz razmjenu protona:
- kiselina oslobađa proton (H⁺),
- baza prihvata proton.
Karakteristike ove teorije uključuju:
- kiseline su donori protona,
- baze su akceptori protona,
- dozvoljene su vodene otopine,
- baze ne moraju biti hidroksidi,
- prihvataju se isključivo protne kiseline.
Osobine kiselina i baza
Kiseline se mogu prepoznati po:
- kiselom ukusu,
- korozivnom djelovanju,
- sposobnosti da provode električnu struju u vodenim rastvorima,
- reakcijama s bazama pri čemu nastaju so i voda.
Baze se razlikuju po:
- gorkom ukusu,
- klizavom ili sapunastom osjećaju na dodir,
- ne mijenjaju boju plavog lakmus papira.
Primjeri kiselina i baza
Česte kiseline u svakodnevnom životu:
- limunska kiselina,
- mliječna kiselina,
- sirćetna kiselina (sirće),
- ugljična kiselina,
- askorbinska kiselina (vitamin C).
Najčešće baze:
- sapuni,
- deterdženti,
- lužina,
- kućni amonijak.
Zašto su osnove hemije temelj razumijevanja svijeta oko nas
Poznavanje osnovnih pojmova hemije omogućava nam da lakše razumijemo prirodne procese, tehnologiju i promjene koje se dešavaju u svakodnevnom životu. Od hemijskih veza i reakcija do kiselina, baza i strukture molekula, hemija pruža alate za kritičko razmišljanje i sigurnu primjenu znanja u praksi. Upravo zato su osnovi hemije ključni ne samo za obrazovanje, već i za donošenje informisanih odluka u savremenom društvu. Ključni koncepti hemije, poput atomske strukture, hemijskih reakcija i periodnog sistema, univerzalni su bez obzira na obrazovni sistem ili državu, a u Bosni i Hercegovini oni predstavljaju temelj za dalje obrazovanje u oblastima medicine, inženjerstva i prirodnih nauka.
Sažmi uz pomoć AI















